สสาร ( Matter )
Homepage
สสาร ( Matter )
สสาร ( Matter ) คือสิ่งที่มีมวล ต้องการที่อยู่ และสามารถสัมผัสได้ หรืออาจหมายถึงสิ่งต่าง ๆ ที่อยู่รอบตัวเรา มีตัวตน ต้องการที่อยู่ สัมผัสได้ อาจมองเห็นหรือมองไม่เห็นก็ได้ ดังนั้นอาจกล่าวได้ว่าสิ่งต่าง ๆ ที่อยู่รอบตัวเรานั้น ล้วนเป็น สสาร ทั้งสิ้น เช่น อากาศ หิน ดิน น้ำ ต้นไม้ สัตว์ บ้าน รถ หรือแม้กระทั้งตัวเราเองเป็นต้น
สาร ( Substance ) คือสสารที่ศึกษาค้นคว้าจนทราบสมบัติและองค์ประกอบที่แน่นอน สารทุกชนิดจะมีลักษณะเฉพาะตัวที่สามารถนำมาใช้ระบุชนิดของสาร ลักษณะเฉพาะตัวนี้เรียกว่า สมบัติของสาร
สมบัติของสาร หมายถึง ลักษณะเฉพาะตัวของสาร เช่น เนื้อสาร สี กลิ่น รส การนำไฟฟ้า การละลายน้ำ จุดเดือด จุดหลอมเหลว ความเป็นกรด – เบส เป็นต้น
ตัวอย่าง สมบัติของน้ำบริสุทธิ์
ไม่มีสี ไม่มีกลิ่น ไม่มีรส มีจุดเดือด = 100 °C และ จุดเยือกแข็ง = 0 °C
นักวิทยาศาสตร์แบ่งสมบัติของสารออกเป็น 2 ประเภท คือ
- สมบัติทางกายภาพ หรือสมบัติทางฟิสิกส์ ( Physical Properties ) หมายถึง สมบัติของสารที่สามารถสังเกตได้จากลักษณะภายนอก หรือจากการทดลองที่ไม่เกี่ยวข้องกับปฏิกิริยาเคมี เช่น สถานะ เนื้อสาร สี กลิ่น รส ความแข็ง ความอ่อน ความเหนียว ความหนาแน่น จุดเดือด จุดหลอมเหลว การนำไฟฟ้า การละลายน้ำ ความถ่วงจำเพาะ ความร้อนแฝง เป็นต้น ซึ่งสมบัติทางกายภาพสามารถสังเกตลักษณะ ทางกายภาพของสารได้โดยการใช้ประสาทสัมผัสหรือใช้อุปกรณ์ที่ประดิษฐ์ขึ้น เช่น เครื่องวัดความหนาแน่น เครื่องวัดการนำไฟฟ้า เครื่องวัดความชื้น เป็นต้น
- สมบัติทางเคมี ( Chemical Properties ) หมายถึง สมบัติของสารที่เกี่ยวข้องกับองค์ประกอบภายในของสารที่แสดงออกมาให้เห็นเมื่อมีการเปลี่ยนแปลงทางเคมีหรือการเกิดปฏิกิริยาเคมี โดยจะมีสารใหม่เกิดขึ้น ซึ่งสารใหม่ที่เกิดขึ้นจะมีสมบัติแตกต่างไปจากเดิม เช่น การติดไฟ การผุกร่อน การทำปฏิกิริยากับน้ำ การทำปฏิกิริยากับกรด – เบส การเกิดสนิม การเน่าของผัก ผลไม้ เป็นต้น
สถานะของสาร
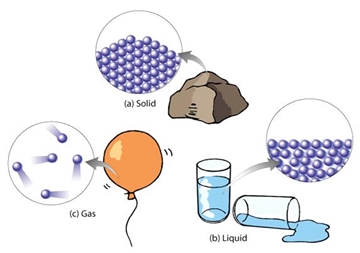
เมื่อจำแนกสารโดยใช้การจัดเรียงตัวของอนุภาคที่เป็นองค์ประกอบเป็นเกณฑ์ สารแบ่งออกเป็น 3 สถานะ ดังนี้
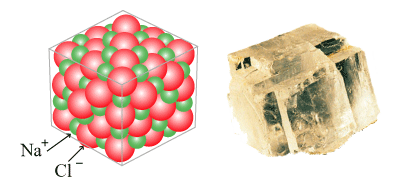
1. ของแข็ง ( Solid )
หมายถึงสารที่มีลักษณะรูปร่างและปริมาตรคงที่ มีรูปร่างเฉพาะตัว เนื่องจากอนุภาคในของแข็งจัดเรียงชิดติดกันและอัดแน่นอย่างมีระเบียบ มีแรงยึดเหนี่ยวระหว่างกันสูงมากทำให้อนุภาคไม่มีการเคลื่อนที่หรือเคลื่อนที่ได้น้อยมาก เปลี่ยนแปลงรูปร่างได้ยาก เช่น ไม้ หิน เหล็ก ทองคำ ดิน ทราย พลาสติก กระดาษ น้ำตาล เกลือแกง ตะกั่ว ถ่านไฟฉาย ยางรถยนต์ เป็นต้น
สมบัติเพิ่มเติมของ ของแข็ง
การเปลี่ยนสถานะของแข็ง
- การหลอมเหลว เมื่อให้ความร้อนแก่ของแข็ง อนุภาคของของแข็งจะมีพลังงานจลน์เพิ่มขึ้น ทำให้อนุภาคมีการสั่นมากขึ้น และมีการถ่ายโอนพลังงานให้แก่อนุภาคข้างเคียงอย่างต่อเนื่อง จนกระทั่งบางอนุภาคของของแข็งมีพลังงานสูงกว่าแรงยึดเหนี่ยวระหว่างอนุภาค อนุภาคของของแข็งจึงเริ่มเคลื่อนที่และอยู่ห่างกันมากขึ้น ของแข็งจึงเกิดการเปลี่ยนสถานะเป็นของเหลว เรียกว่า การหลอมเหลว ( Melting ) และเรียกอุณหภูมิในขณะที่ของแข็งเปลี่ยนสถานะเป็นของเหลวว่า จุดหลอมเหลว ( Melting point )
- การระเหิด เป็นการเปลี่ยนแปลงที่เกิดกับสารชนิดที่ไม่มีขั้วหรือมีขั้วน้อยมาก และมีแรงยึดเหนี่ยวระหว่างอนุภาคเป็นแรงแวนเดอร์วาลส์ ( Van der Waals forces ) อย่างอ่อน เช่น แรงลอนดอน เมื่ออนุภาคของสารได้รับความร้อนจากสิ่งแวดล้อมเพียงเล็กน้อย จะทำให้อนุภาคของสารนั้นแยกออกจากผลึก โดยเฉพาะอนุภาคที่อยู่บริเวณผิวหน้าของผลึกจะหลุดออกและเคลื่อนที่เป็นอิสระได้ง่าย เช่น การระเหิดของไอโอดีน การระเหิดของแนฟทาลีน การบูร เมนทอล เป็นต้น
2. ของเหลว ( Liquid )
หมายถึงสารที่มีปริมาตรคงที่ แต่รูปร่างเปลี่ยนไปตามภาชนะที่บรรจุ สามารถไหลได้ เนื่องจากอนุภาคในของเหลวอยู่ห่างกันมากกว่าของแข็ง อนุภาคไม่ยึดติดกันจึงสามารถเคลื่อนที่ได้ในระยะใกล้ และมีแรงดึงดูดซึ่งกันและกัน สามารถทะลุผ่านได้ เช่น น้ำ แอลกอฮอล์ น้ำมันพืช น้ำมันเบนซิน น้ำส้มสายชู น้ำหมึก น้ำอัดลม น้ำปลา เป็นต้น

สมบัติเพิ่มเติมของ ของเหลว
- ความหนาแน่น ( Density ) ของของเหลว ถ้าโมเลกุลของของเหลวมีแรงยึดเหนี่ยวซึ่งกันและกันมาก โมเลกุลจะเข้าใกล้กันมากขึ้น ทำให้ความหนาแน่นของของเหลวนั้นสูง
- แรงตึงผิว ( Surface tension ) เกิดจากความไม่สมดุลของแรงยึดเหนี่ยวระหว่างโมเลกุลที่บริเวณผิวหน้าของของเหลว โมเลกุลที่อยู่ภายในจะมีแรงยึดเหนี่ยวระหว่างโมเลกุลกับโมเลกุลอื่นทุกทิศทุกทางในขณะที่ที่ผิวหน้าของของเหลว โมเลกุลของเหลวบริเวณนี้จะมีแรงยึดเหนี่ยวระหว่างโมเลกุลกับโมเลกุลภายในเท่านั้น ด้านบนไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุล จึงเกิดแรงดึงเข้าภายในซึ่งแรงนั้นคือแรงตึงผิว
เสมือนมีผิวมาเคลือบของเหลวไว้ ไม่ยอมให้วัตถุผ่านเข้าไป เป็นการพยายามลดพื้นที่ผิวให้น้อยลง
ดังจะเห็นได้จากจิงโจ้น้ำเดินบนผิวน้ำได้โดยไม่จมลงไป หรือหยดน้ำบนใบบอน บนฝากระโปรงรถที่เคลือบเงาหรือบนผิวแอปเปิลหยดน้ำเหล่านี้จะจับตัวกันเป็นหยดคล้ายทรงกลม เนื่องจากทรงกลมเป็นรูปทรงที่มีพื้นที่ผิวน้อยที่สุด ของเหลวที่มีแรงยึดเหนี่ยวระหว่างโมเลกุลมากจะมีแรงตึงผิวมาก เช่นน้ำซึ่งมีพันธะไฮโดรเจนก็จะมีแรงตึงผิวมากกว่าของเหลวชนิดอื่น ๆ
- ความหนืด ซึ่งเกิดจากแรงยึดเหนี่ยวระหว่างโมเลกุล ถ้ามีแรงยึดเหนี่ยวระหว่างโมเลกุลมากเท่าไร โมเลกุลจะอยู่ใกล้ชิดกันมากขึ้น ทำให้มีความหนาแน่น แรงตึงผิว และความหนืดมากขึ้นด้วย
- ความหนืด ซึ่งเกิดจากแรงยึดเหนี่ยวระหว่างโมเลกุล ถ้ามีแรงยึดเหนี่ยวระหว่างโมเลกุลมากเท่าไร โมเลกุลจะอยู่ใกล้ชิดกันมากขึ้น ทำให้มีความหนาแน่น แรงตึงผิว และความหนืดมากขึ้นด้วย
การระเหย ( Evaporation ) คือ การเปลี่ยนสถานะของสารจากของเหลวเป็นแก๊ส โดยที่การระเหยสามารถเกิดได้ทุกอุณหภูมิและเกิดเฉพาะผิวหน้าของของเหลวเท่านั้น การระเหยเกิดขึ้น เนื่องจากโมเลกุลของของเหลวมีการเคลื่อนที่ตลอดเวลา โดยไม่มีทิศทางการเคลื่อนที่แน่นอน บางโมเลกุลอาจเคลื่อนที่มาชนกันจึงมีการถ่ายเทพลังงานจลน์ระหว่างกันและกัน ภายหลังการชนบางโมเลกุลมีพลังงานจลน์สูงขึ้น แต่บางโมเลกุลมีพลังงานจลน์ต่ำลง โมเลกุลซึ่งมีพลังงานจลน์สูงกว่า แรงยึดเหนี่ยวระหว่างโมเลกุลและอยู่ที่ผิวหน้าของของเหลวจะสามารถแยกตัวอออกจากของเหลว เกิดการเปลี่ยนสถานะเป็นแก๊ส โมเลกุลที่เหลืออยู่มีพลังงานจลน์ต่ำลงจึงต้องดูดพลังงาน ดังนั้น เมื่อเหงื่อแห้งจะรู้สึกเย็นเพราะเมื่อเหงื่อบางส่วนระเหยไป เหงื่อส่วนที่เหลือจะมีพลังงานต่ำจึงต้อง ดูดพลังงานจากผิวหนังทำให้รู้สึกเย็น
3. แก๊ส ( Gas ) หมายถึงสารที่มีรูปร่าง และปริมาตรไม่คงที่ เปลี่ยนไปตามภาชนะที่บรรจุ มีลักษณะฟุ้งกระจายเต็มภาชนะที่บรรจุ เนื่องจากอนุภาคของแก๊สอยู่ห่างกันมาก มีพลังงานในการเคลื่อนที่อย่างรวดเร็วไปได้ในทุกทิศทางตลอดเวลา จึงมีแรงดึงดูดระหว่างอนุภาคน้อยมาก สามารถทะลุผ่านได้ง่าย และบีบอัดให้เล็กลงได้ง่าย เช่น อากาศ แก๊สออกซิเจน แก๊สหุงต้ม ไอน้ำ เป็นต้น
สมบัติเพิ่มเติมของ แก๊ส
1. ถ้าให้แก๊สอยู่ในภาชนะที่เปลี่ยนแปลงปริมาตรได้ ปริมาตรของแก๊สจะขึ้นอยู่กับอุณหภูมิ ความดันและจำนวนโมล ดังนั้นเมื่อบอกปริมาตรของแก๊สจะต้องบอกอุณหภูมิ ความดันและจำนวนโมลด้วย เช่น แก๊สออกซิเจน 1 โมล มีปริมาตร 22.4 dm3 ที่อุณหภูมิ 0 °C ความดัน 1 บรรยากาศ ( STP )
2. สารที่อยู่ในสถานะแก๊สมีความหนาแน่นน้อยกว่าเมื่ออยู่ในสถานะของเหลวและของแข็งมาก เช่น ไอน้ำ มีความหนาแน่น 0.0006 g/cm3 แต่น้ำมีความแน่นถึง 0.9584 g/cm3 ที่100 °C
3. แก๊สสามารถแพร่ได้ และแพร่ได้เร็วเพราะแก๊สมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยกว่าของเหลวและของแข็ง
4. แก๊สต่าง ๆ ตั้งแต่ 2 ชนิดขึ้นไปเมื่อนำมาใส่ในภาชนะเดียวกัน แก๊สแต่ละชนิดจะแพร่ผสมกันอย่างสมบูรณ์ทุกส่วน นั้นคือส่วนผสมของแก๊สเป็นสารเดียว หรือเป็นสารละลาย ( Solution )
5. แก๊สส่วนใหญ่ไม่มีสีและโปร่งใส เช่น แก๊สออกซิเจน ( O2 ) แก๊สไฮโดเจน ( H2 ) แก๊สคาร์บอนไดออกไซด์ ( CO2 ) เป็นต้น



ความคิดเห็น
แสดงความคิดเห็น